Cuatro pasos clave para definir vuestra estrategia de market access antes de entrar en nuevos mercados
El market access and pricing (MA&P) es una parte cada vez más esencial para tener éxito en la estrategia de desarrollo y lanzamiento del producto. Veamos por qué el MA&P es tan esencial, cuál es el calendario adecuado para incorporarlo a la estrategia global, y cómo gestionar el acceso al mercado después del lanzamiento.

¿Por qué es tan importante el MA&P?
En los últimos diez años, los sistemas de atención sanitaria han sido sometidos a mayor presión en sus presupuestos, una tendencia hacia una mayor transparencia y la introducción en el mercado de tecnologías cada vez más complejas y caras. Como resultado, las autoridades sanitarias siguen incorporando nuevos reglamentos y controles para evaluarlas y asegurarlas, y mejorar su eficiencia al tiempo que se hace un seguimiento estricto del gasto sanitario.
Estos elementos han hecho que el MA&P sea esencial para el desarrollo del producto en general. Hasta el punto de que hoy en día, los departamentos de MA&P son habituales en las organizaciones que trabajan las ciencias de la vida, sobre todo en las grandes empresas. Aunque el MA&P no sea un departamento formal, suele estar integrado en las unidades de negocio o forma parte de los asuntos gubernamentales o públicos.
Incluso con mayor presencia de MA&P en las empresas, para maximizar realmente las condiciones de acceso y la determinación de precios, todas las acciones y actividades de MA&P deben planificarse con mucho cuidado y desarrollarlas precozmente para evitar:
- Errores en el posicionamiento y caracterización del producto
- Carencias en la evidencia o diseños erróneos de los estudios (clínicos, sociales, económicos)
- Costes inesperados por la necesidad de nuevos estudios o de adaptar la estrategia de lanzamiento
- Resultados menos buenos que los esperados, incluidas las condiciones de fijación de precios y reembolso (P&R por su sigla en inglés) y los ingresos.
Cuándo se debe definir la estrategia de MA&P?
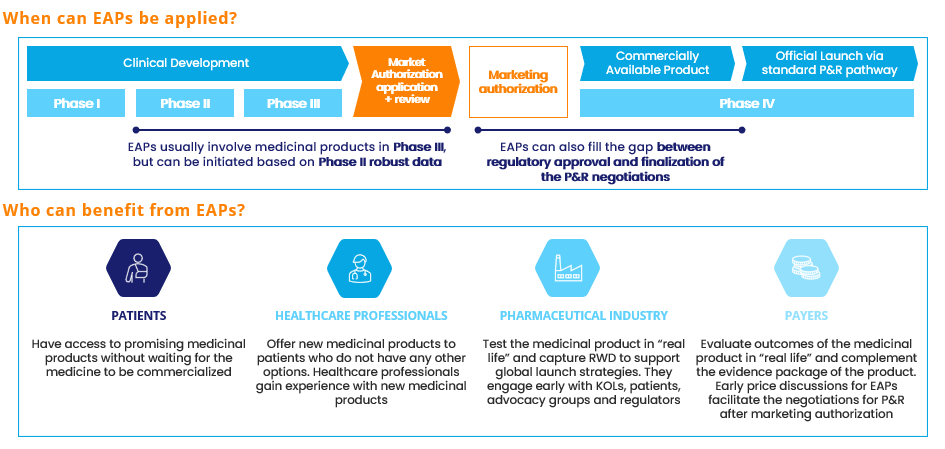
Es esencial definir la estrategia de MA&P en una primera fase -fase I-II para medicamentos y prototipos/pruebas para tecmed. La oportunidad de mercado para un producto específico puede optimizarse mediante:
- La inclusión en el plan clínico de especificidades del mercado que tengan en cuenta las necesidades de desarrollo clínico específicas del país, y la adaptación del diseño del ensayo clínico y otros estudios a realizar (como estudios HEOR y/o RWE) desde la perspectiva del inversor, el médico y el paciente.
- La planificación de un primer lanzamiento implementando o bien los programas de acceso anticipado (EAP, por su sigla en inglés) para los productos farmacéuticos o bien la financiación pública innovadora para el sector tecmed.
- Una sólida justificación económica con evidencia que incluya: supuestos de pruebas con las principales partes interesadas, teniendo en cuenta diferentes escenarios en la población objetivo y las condiciones de P&R, y una lista de indicadores de alerta para un seguimiento esmerado.
Figura 1. Visión general de los programas de acceso anticipad (EAP). Fuente: Alira Health
¿Cuáles son los principales pasos para el MA&P en el ciclo de vida del desarrollo?
Si bien la evaluación temprana es el primer paso para el MA&P, hay trabajo adicional a lo largo del ciclo de vida de desarrollo del producto. Llamado acceso al mercado en fase posterior, lospróximos pasos comienzan durante las fases II-III para los medicamentos y la validación para tecmed, dado el volumen de trabajo requerido.
Establecer una buena comprensión del mercado y el sistema de atención sanitaria
Esto incluye el tipo de atención sanitaria que se proporciona, su organización y el gasto, los posibles canales comerciales y de venta, la normativa específica y los principales organismos. También es necesario tener una buena comprensión de las vías de acceso —los diferentes procesos de evaluación de las tecnologías sanitarias (ATS) y de fijación de precios y reembolso (P&R), el nivel de evidencia necesario, los principales factores de decisión y los mecanismos de fijación de precios. Tanto los procesos de ATS como de P&R son esenciales para el acceso al mercado.
- Evaluación de tecnologías sanitarias (ATS): Evaluación sistemática de las propiedades y efectos de la tecnología, comparando el beneficio añadido respecto a las alternativas existentes. Esto siempre se realiza desde una perspectiva clínica, pero en algunos países también incluye una evaluación económica.
- Negociaciones de fijación de precios y reembolso (P&R): Las negociaciones sobre el reembolso público, el precio a pagar (precio bruto y neto en su caso) y la implementación de una contratación innovadora, incluidos los acuerdos financieros y basados en el rendimiento.
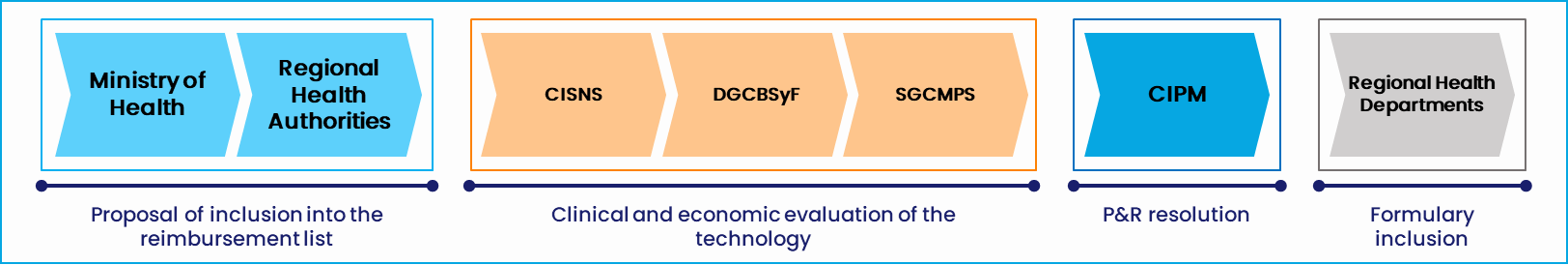
Figura 2. Proceso de ATS y P&R a Espanya. Fuente: Alira Health
En relación con las vías de acceso, para entrar en cada mercado de manera adecuada es esencial cartografiar detalladamente las partes interesadas y entender la relevancia y funciones en el proceso de decisión de los diferentes organismos de ATS y P&R, los líderes de opinión (KOL por la sigla en inglés) y los representantes de pacientes. Para otras actividades, como el compromiso clínico y la estructura comercial, es necesario cartografiar los hospitales de referencia y también pueden hacer falta los KOL, las farmacias de hospital y minoristas y las asociaciones de pacientes, según de qué enfermedad se trate.
Al mismo tiempo, si se determina correctamente la dimensión del mercado puede ilustrarse el valor real de la oportunidad, el panorama atual del mercado, los productos en preparación (posibles terapias futuras que entrarán en el mercado) y el reparto del mercado. Todo esto se incluye en la justificación económica mediante aportación de datos para diferentes escenarios previstos. Junto con el dimensionamiento cuantitativo del mercado, la investigación cualitativa es clave para comprender los planes de salud nacionales (y regionales) para la enfermedad, el valor del producto comparado con otras alternativas de tratamiento, el posicionamiento del producto y las conductas de prescripción y administración.
Probar el mensaje del inversor y anticipar sus objeciones
Una vez definida la proposición de valor desde la perspectiva médica, el siguiente paso es adaptarla a la perspectiva del inversor probando los mensajes del inversor y previendo sus objeciones. Con esta investigación también se pretende validar los supuestos sobre la vía de acceso y los principales impulsores de decisiones, mediante una evaluación de su percepción de las necesidades clínicas no satisfechas y la carga de la enfermedad, y probando el perfil del producto objetivo ( TPP, por su sigla en inglés) para obtener una estimación precisa de las condiciones de precios y las restricciones de acceso.
Es importante probar y validar todos los temas desde la perspectiva del paciente. Con demasiada frecuencia se ignora la voz del paciente, pero el mercado está empezando a adoptar una visión orientada al paciente.
Preparar un paquete de valor y modelos económicos
Una vez validados todos los supuestos y mensajes de valor, se puede empezar la preparación del paquete de valor y los modelos económicos —incluso antes de disponer de los resultados clínicos finales. El paquete de valor incluye el dossier de valor con la evidencia clínica (eficacia y seguridad) y social (QoL e impacto económico) que es necesario presentar a las agencias nacionales, así como cualquier otro material relevante. Los modelos económicos pueden ser un impacto presupuestario o un modelo de rentabilidad, según el mercado.
Llevar a cabo las negociaciones de P&R
Tras presentar la evidencia a las autoridades, el último paso antes de entrar al mercado es la negociación de P&R. Con la preparación del material adecuado y la investigación del mercado, una buena planificación de la negociación y buenos socios, las negociaciones deben ser fáciles, sin dificultades ni contratiempos imprevistos.
¿Qué ocurre después de entrar en el mercado?
Con una sólida estrategia de MA&P, el producto tendrá un lanzamiento de éxito. Pero el acceso al mercado no termina con el lanzamiento del producto. Es necesario realizar actividades operativas mientras se comercializa. Todas estas actividades requieren sus propias estrategias para tener éxito e incluyen la generación de evidencia con datos reales (RWE, por su sigla en inglés), renegociaciones y revisiones de la evidencia y los precios, implementación de los acuerdos de entrada gestionados, gestión de la competencia y de la pérdida de exclusividad; y la mitigación del comercio paralelo.
Escoger el socio adecuado para su estrategia de MA&P es esencial para entrar en el mercado y para llevar a cabo todas las actividades postlanzamiento. La profunda experiencia de Alira Health y su planteamiento interfuncional le puede orientar durante todas las fases de desarrollo del producto. Puede obtener más información sobre la experiencia de Alira Health poniéndose en contacto con su equipo de expertos en info@alirahealth.com o visitando el sitio web www.alirahealth.com.
Lista de abreviaturas:
- CIPM: Comisión Interministerial de Precios de los Medicamentos
- CISNS: Consejo Interterritorial del Sistema Nacional de Salud español
- DGCBSiF: Dirección General de Cartera Básica de Servicios y Farmacia
- EAP: Programa de acceso anticipado (Early Access Program)
- HEOR: Economía de la salud e investigación de resultados (Health economics and outcomes research)
- KOL: Líder de opinión (Key opinion leader)
- P&R: Fijación de precios y reembolso (Pricing and reimbursement)
- QoL: Calidad de vida (Quality of life)
- RWE: Evidencia con datos reales (Real-world evidence)
- SGCMPS: Subdirección General de Calidad de los Medicamentos y Productos Sanitarios
- TPP: Perfil del producto objetivo (Target product profile)
- MA&P: acceso al mercado y fijación del precio
Este artículo ha sido redactado por Chus Castillo y Marc Manau, director global y asesor senior de acceso al mercado y fijación de precios de Alira Health, principal contribuyente del Informe de la BioRegión 2021. Lee el capítulo completo sobre la estrategia de acceso al mercado”.