Quatre passos clau per definir la vostra estratègia de market access abans d’entrar en nous mercats
El market access and pricing (MA&P) és una part cada vegada més essencial per tenir èxit en l’estratègia de desenvolupament i llançament del producte. Vegem per què el MA&P és clau, quin és el calendari adequat per incorporar-lo a l'estratègia global, i com gestionar l’accés al mercat després del llançament.

Per què és tan important el MA&P?
En els darrers deu anys, els sistemes d’atenció sanitària han estat sotmesos a més pressió en els seus pressupostos, una tendència cap a una major transparència i la introducció al mercat de tecnologies cada vegada més complexes i cares. Com a resultat, les autoritats sanitàries continuen incorporant nous reglaments i controls per avaluar-les i assegurar-les, i millorar-ne l’eficiència al mateix temps que es fa un seguiment estricte de la despesa sanitària.
Aquests elements han fet que el MA&P sigui essencial per al desenvolupament del producte en general. Fins al punt que avui dia, els departaments de MA&P són habituals en les organitzacions que treballen les ciències de la vida, sobretot en les empreses grans. Encara que el MA&P no sigui un departament formal, sol estar integrat en les unitats de negoci o forma part dels afers governamentals o públics.
Fins i tot amb més presència del MA&P a les empreses, per maximitzar realment les condicions d’accés i la determinació de preus, totes les accions i activitats del MA&P s’han de planificar amb molt de compte i desenvolupar-les amb anterioritat per evitar:
- Errors en el posicionament i la caracterització del producte
- Mancances en l’evidència o dissenys erronis dels estudis (clínics, socials, econòmics)
- Costos inesperats per la necessitat de nous estudis o d’adaptar l’estratègia de llançament
- Resultats menys bons que els esperats, incloses les condicions de fixació de preus i reemborsament (P&R per la sigla en anglès) i els ingressos.
Quan s’ha de definir l’estratègia de MA&P?
És essencial definir l’estratègia de MA&P en una primera fase —fase I-II per a medicaments i prototips/proves per a tecmed. L’oportunitat de mercat per a un producte específic es pot optimitzar mitjançant:
- La inclusió en el pla clínic d’especificitats del mercat que tinguin en compte les necessitats de desenvolupament clínic específiques del país, i l’adaptació del disseny de l’assaig clínic i altres estudis que calgui dur a terme (com estudis HEOR i/o RWE) des de la perspectiva de l’inversor, el metge i el pacient.
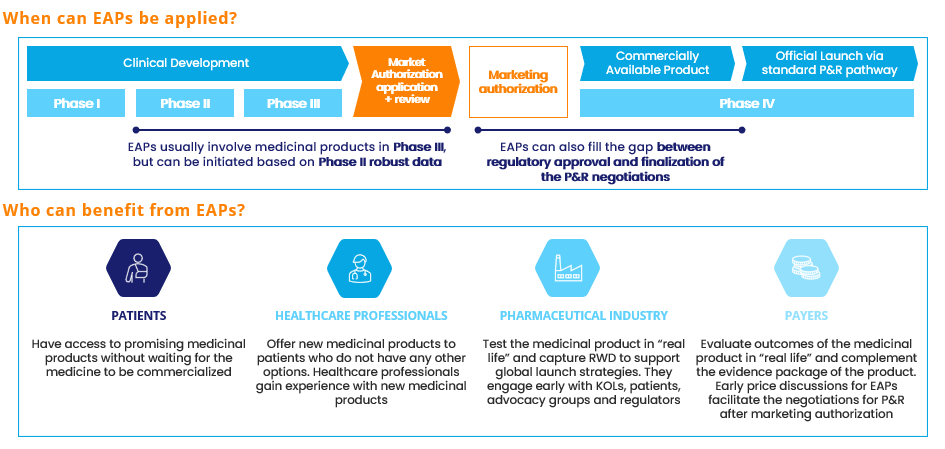
- La planificació d’un primer llançament tot implementant o bé els programes d’accés anticipat (EAP, per la sigla en anglès) per als productes farmacèutics o bé el finançament públic innovador per al sector tecmed.
- Una justificació econòmica sòlida amb evidència que inclogui: supòsits de proves amb les principals parts interessades, tenint en compte diferents escenaris en la població objectiu i les condicions de P&R, i una llista d’indicadors d’alerta per a un seguiment acurat.
Figura 1. Visió general dels programes d’accés anticipat (EAP). Font: Alira Health
Quins són els principals passos per a el MA&P en el cicle de vida del desenvolupament?
Malgrat que l’assessorament previ és el primer pas per al MA&P, hi ha una tasca addicional durant el cicle de vida de desenvolupament del producte. S'anomena accés al mercat en fases posteriors, i comprén els propers passos que comencen durant les fases II-III per als medicaments i la validació per a tecmed, atès el volum de feina que requereix.
Establir una bona comprensió del mercat i el sistema d’atenció sanitària
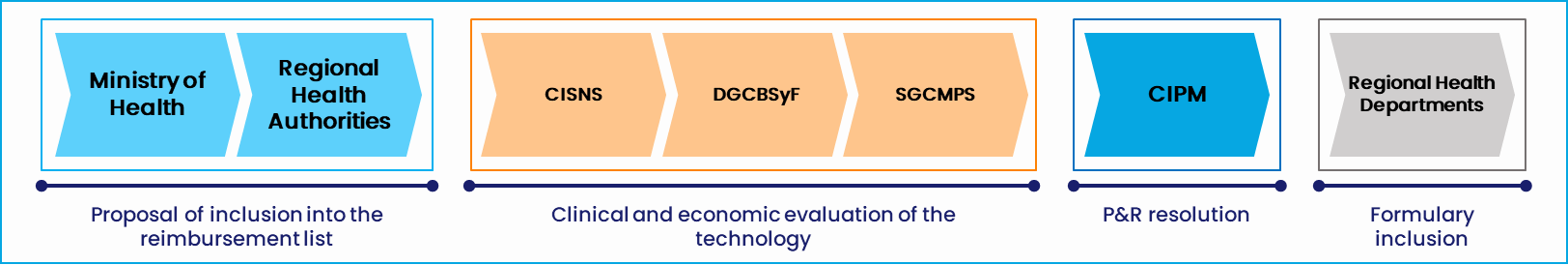
Això inclou el tipus d’atenció sanitària que es proporciona, la seva organització i la despesa, els possibles canals comercials i de venda, la normativa específica i els organismes principals. També cal tenir una bona comprensió de les vies d’accés —els diferents processos d’avaluació de les tecnologies sanitàries (ATS) i de fixació de preus i reemborsament (P&R), el nivell d’evidència que cal, els principals factors de decisió i els mecanismes de fixació de preus. Tant els processos d’ATS com de P&R són essencials per a l’accés al mercat.
- Avaluació de tecnologies sanitàries (ATS): Assessorament sistemàtic de les propietats i els efectes de la tecnologia, tot comparant el benefici afegit respecte de les alternatives existents. Això sempre es fa des d’una perspectiva clínica, però en alguns països també inclou una avaluació econòmica.
- Negociacions de fixació de preus i reemborsament (P&R): Les negociacions sobre el reemborsament públic, el preu que s’ha de pagar (preu brut i net si és el cas) i la implementació d’una contractació innovadora, inclosos els acords financers i basats en el rendiment.
Figura 2. Procés d’ATS i P&R a Espanya. Font: Alira Health
En relació amb les vies d’accés, per entrar a cada mercat de manera adequada és essencial cartografiar detalladament les parts interessades i entendre la rellevància i les funcions en el procés de decisió dels diferents organismes d’ATS i P&R, els líders d’opinió (KOL per la sigla en anglès) i els representants de pacients. Per a altres activitats, com el compromís clínic i l’estructura comercial, cal cartografiar els hospitals de referència i també poden fer falta els KOL, les farmàcies tant d’hospital com detallistes i les associacions de pacients, segons de quina malaltia es tracti.
Al mateix temps, si es determina correctament la dimensió del mercat es pot il·lustrar el valor real de l’oportunitat, el panorama comercial actual i els productes en preparació (possibles teràpies futures que entraran al mercat) i el repartiment del mercat. Tot això s’inclou en la justificació econòmica mitjançant aportació de dades per a diferents escenaris previstos. Juntament amb la determinació quantitativa del mercat, la recerca qualitativa del mercat és clau per entendre els plans de salut nacionals (i regionals) per a la malaltia, el valor del producte comparat amb altres alternatives de tractament, el posicionament del producte i les conductes de prescripció i administració.
Provar el missatge de l’inversor i anticipar les seves objeccions
Un cop definida la proposició de valor des de la perspectiva mèdica, el següent pas és adaptar-la a la perspectiva de l’inversor tot provant els missatges de l’inversor i preveient les seves objeccions. Amb aquesta recerca també es pretén validar els supòsits sobre la via d’accés i els principals impulsors de decisions, mitjançant una avaluació de la seva percepció de les necessitats clíniques no satisfetes i la càrrega de la malaltia, i provant el perfil del producte objectiu (TPP, per la sigla en anglès) per tal d’obtenir una estimació precisa de les condicions de preus i les restriccions d'accés.
És important provar i validar tots els temes des de la perspectiva del pacient. Massa sovint s’ignora la veu del pacient, però el mercat està començant a adoptar una visió orientada al pacient.
Preparar un paquet de valor i models econòmics
Un cop validats tots els supòsits i els missatges de valor, es pot començar la preparació del paquet de valor i els models econòmics —fins i tot abans de disposar dels resultats clínics finals. El paquet de valor inclou el dossier de valor amb l’evidència clínica (eficàcia i seguretat) i social (QoL i impacte econòmic) que cal presentar a les agències nacionals, així com qualsevol altre material rellevant. Els models econòmics poden ser o bé un impacte pressupostari o un model de rendibilitat, segons el mercat.
Dur a terme les negociacions de P&R
Després de presentar l'evidència a les autoritats, el darrer pas abans d’entrar al mercat és la negociació de P&R. Amb la preparació del material adequat i la investigació del mercat, una bona planificació de la negociació i uns bons socis de negociació, les negociacions han de ser fàcils, sense dificultats ni conflictes imprevistos.
Què passa després d’entrar al mercat?
Amb una estratègia de MA&P sòlida, el producte tindrà un llançament d’èxit. Però l’accés al mercat no s’acaba aquí, cal dur a terme activitats operatives mentre es comercialitza el producte. Totes aquestes activitats requereixen les seves pròpies estratègies per tenir èxit i inclouen la generació d’evidència amb dades reals (RWE, per la sigla en anglès), renegociacions i revisions de l’evidència i els preus, implementació dels acords d’entrada gestionats, gestió de la competència i de la pèrdua d’exclusivitat, i la mitigació del comerç paral·lel.
Escollir el soci adequat per a la vostra estratègia de MA&P és essencial per entrar al mercat i per dur a terme totes les activitats postllançament. La profunda experiència d’Alira Health i el seu plantejament interfuncional us pot orientar durant totes les fases de desenvolupament del producte. Podeu obtenir més informació sobre l’experiència d’Alira Health posant-vos en contacte amb el seu equip d’experts a info@alirahealth.com o visitant el lloc web www.alirahealth.com.
Llistat d’abreviatures:
- CIPM: Comissió Interministerial de Preus dels Medicaments
- CISNS: Consell Interterritorial del Sistema Nacional de Salut espanyol
- DGCBSiF: Direcció General de Cartera Bàsica de Serveis i Farmàcia
- EAP: Programa d’accés anticipat (Early Access Program)
- HEOR: Economia de la salut i investigació de resultats (Health economics and outcomes research)
- KOL: Líder d’opinió (Key opinion leader)
- P&R: Fixació de preus i reemborsament (Pricing and reimbursement)
- QoL: Qualitat de vida (Quality of life)
- RWE: Evidència amb dades reals (Real-world evidence)
- SGCMPS: Subdirecció General de Qualitat dels Medicaments i Productes Sanitaris
- TPP: Perfil del producte objectiu (Target product profile)
- MA&P: accés al mercat i fixació del preu
Aquest article ha estat redactat per Chus Castillo i Marc Manau, director global i assessor sènior d’accés al mercat i fixació de preus d’Alira Health, principal contribuent de l’Informe de la BioRegió 2021. Llegeix el capítol complet sobre l'estratègia d'accés al mercat”.